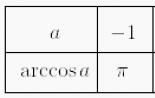
Химия. Отношение металлов к кислотам Некоторыесоли разлагаются при нагревании
С разбавленными кислотами, которые проявляют окислительные свойства за счет ионов водорода (разбавленные серная, фосфорная, сернистая, все бескислородные и органические кислоты и др.)
реагируют металлы:
расположенные в ряду напряжений до водорода
(эти металлы способны
вытеснять водород из кислоты);
образующие с этими кислотами растворимые соли
(на поверхности этих металлов
не образуется защитная солевая
пленка).
В результате реакции образуются растворимые соли
и выделяется водород:
2А1 + 6НСI = 2А1С1 3 + ЗН 2
М
g
+ Н 2
SO
4
=
М
gS
О 4
+ Н 2
разб.
С
u
+ Н 2
SO
4
→
X
(так
как С
u
стоит после Н 2)
разб.
РЬ + Н 2
SO
4
→
X
(так
как РЬ
SO
4
нерастворим
в воде)
разб.
Некоторые кислоты являются окислителями за счет элемента, образующего кислотный
остаток, К ним относятся концентрированная серная, а также азотная кислота
любой концентрации. Такие кислоты называют кислотами-окислителями.

Окислительные свойства кислотных остатков и значительно сильнее, чем нона водорода Н, поэтому азотная и концентрированная серная кислоты взаимодействуют практически со всеми металлами, расположенными в ряду напряжений как до водорода, так и после него, кроме золота и платины. Так как окислителями в этих случаях являются ноны кислотных остатков (за счет атомов серы и азота в высших степенях окисления), а не ноны водорода Н, то при взаимодействии азотной, а концентрированной серной кислот с металлами не выделяется водород. Металл под действием данных кислот окисляется до характерной (устойчивой) степени окисления и образует соль, а продукт восстановления кислоты зависит от активности металла и степени разбавления кислоты

Взаимодействие серной кислоты с металлами
Разбавленная и концентрированная серные кислоты ведут себя по-разному. Разбавленная серная кислота ведет себя, как обычная кислота. Активные металлы, стоящие в ряду напряжений левее водорода
Li, К , Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
вытесняют водород из разбавленной серной кислоты. Мы видим пузырьки водорода при добавлении разбавленной серной кислоты в пробирку с цинком.
H 2 SO 4 + Zn = Zn SO 4 + H 2
Медь стоит в ряду напряжений после водорода – поэтому разбавленная серная кислота не действует на медь. А в концентрированной серной кислоты, цинк и медь, ведут себя таким образом…
Цинк, как активный металл, может образовывать с концентрированной серной кислотой сернистый газ, элементарную серу, и даже сероводород.
2H 2 SO 4 + Zn = SO 2 +ZnSO 4 + 2H 2 O
Медь - менее активный металл. При взаимодействии с концентрированно серной кислотой восстанавливает ее до сернистого газа.
2H 2 SO 4 конц. + Cu = SO 2 + CuSO 4 + 2H 2 O
В пробирках с концентрированной серной кислотой выделяется сернистый газа.
Следует иметь в виду, что на схемах указаны продукты, содержание которых максимально среди возможных продуктов восстановления кислот.
На основании
приведенных схем составим уравнения конкретных реакций — взаимодействия меди и
магния с концентрированной серной кислотой:
0 +6
+2 +4
С
u
+ 2Н 2
SO
4
= С
uSO
4
+
SO
2
+ 2Н 2
O
конц.
0 +6 +2 -2
4М
g
+ 5Н 2
SO
4
= 4М
gSO
4
+ Н 2
S
+ 4Н 2
O
конц.
Некоторые металлы ( Fe . АI, С r ) не взаимодействуют с концентрированной серной и азотной кислотами при обычной температуре, так как происходит пассивации металла. Это явление связано с образованием на поверхности металла тонкой, но очень плотной оксидной пленки, которая и защищает металл. По этой причине азотную и концентрированную серную кислоты транспортируют в железных емкостях.
Если металл проявляет переменные степени окисления, то с кислотами, являющимися
окислителями за счет ионов Н + , он образует соли, в которых его
степень окисления ниже устойчивой, а с кислотами-окислителями — соли, в которых
его степень окисления более устойчива:
0 +2
F
е+Н 2
SO
4
=
F
е
SO
4
+Н 2
0 разб. +
3
F
е+Н 2
SO
4
=
F
е 2 (SO 4
) 3 + 3
SO 2
+ 6Н 2
O
конц
И.И.Новошинский
Н.С.Новошинская
I) Кислота + металл = соль
1. Стоящие до Н металлы в ряду напряженности вытесняют из сильных кислот Н.
Zn + 2HCl = ZnCl 2 + H 2 ,
2. Стоящие после Н металлы вытесняют другие газы.
3Cu + 8HNO 3(разб) = 3Сu (NO 3) 2 +2NO+4H 2 O
II) Кислота + основание (р-я нейтролизации)
H 2 SO 4 + 2NaOH = Na 2 SO 4 + 2H 2 O.
III) Кислота + основный оксид
H 2 SO 4 + Na 2 O = Na 2 SO 4 + 2H 2 O.
IV) Кислоты реагируют с солями, если реагирующая кислота сильнее, чем соль или если образуется осадок.
HCI + AgNO 3 → AgCI + HNO 3
Получение.
1. Кисл.оксид + вода
SO 3 +H 2 O=H 2 SO 4
CO 2 +H 2 O=HCO 3
2. Бескислородные кислоты
o Взаимодействие простых веществ
o При действии на соли сильными кислотами, выделяются более слабые.
K 2 S + 2HNO 3 = 2KNO 3 + H 2 S
8.Соли, их классификации, химические свойства и получение.
Соли – сложные вещества, состоящие из атомов металлов и кислотных остатков.
Классификация.
1.Средние соли – все атомы водорода в кислоте замещены металлом.
2.Кислые соли – не все атомы водорода в кислоте замещены металлом. Разумеется, кислые соли могут образовывать только двух- или многоосновные кислоты. Одноосновные кислоты кислых солей давать не могут: NaHCO 3 , NaH 2 PO 4 ит. д.
3. Соли основные - можно рассматривать как продукты неполного, или частичного, замещения гидроксильных групп оснований кислотными остатками: Аl(OH)SO 4 , Zn(OH)Cl и т.д.
4. Двойные соли – атомы водорода двух- или многоосновной кислоты замещены не одним металлом, а двумя различными: NaKCO 3 , KAl(SO 4) 2 и т.д.
Комплексные соли
Химические свойства.
Некоторыесоли разлагаются при нагревании
CaCO 3 = CaO + CO 2
2)Соль + кислота= новая соль и новая кислота. Для осуществление этой реакции необходимо, чтобы кислота была более сильная чем соль, на которую воздействует кислота:
2NaCl + H 2 SO 4 → Na 2 SO 4 + 2HCl.
3)Соль + основание = новая соль и новое основание:
Ba(OH) 2 + Mg SO 4 → BaSO 4 ↓ + Mg(OH) 2 .
4)Соль + Соль = новая соль
NaCl + AgNO 3 → AgCl + NaNO 3 .
Взаимодействуют с металлами(левее металла, входящего в состав соли)
Fe + CuSO 4 → FeSO 4 + Cu↓.
Получение.
1. Кислота+основание
3 . Основание + кисл.оксид
5 . Кислота+соль
7 . Соль+соль
9 . Металл+неметалл
9.Растворы. Виды дисперсных систем. Примеры. Процентная концентрация растворов. Решить задачу на процентную концентрацию.
Растворы – это гомогенная физико-химическая система, состоящая из 2-х или более компонентов и продуктов их взаимодействия.
Важной характеристикой раствора является его состав.
Компоненты агрегатное состояние которых не меняется при образовании раствора называют растворителем. Если оба компонента до растворения находились в одинаковом агр.состоянии (этанол и вода), то растворителем является тот,кто в избытке
Растворы могут находиться в разных агр.состояниях:
1) Газовые (воздух)
2) Жидкие (Водные и неводные:спиртовые и масляные)
3) Твердые (сплавы металлов)
Растворимостью вещества называется способность его частиц равномерно распределяться между частицами растворителя.
Концентрацией раствора называют количество растворенного вещества, содержащееся в определенном количестве раствора или растворителя.
I) Массовая доля растворенного вещества
II) Молярная концентрация вещества (См) – отношение количества вещества к объему раствора
ОТНОШЕНИЕ МЕТАЛЛОВ К КИСЛОТАМ
Чаще всего в химической практике используются такие сильные кислоты как серная H 2 SO 4 , соляная HCl и азотная HNO 3 . Далее рассмотрим отношение различных металлов к перечисленным кислотам.
Соляная кислота ( HCl )
Соляная кислота – это техническое название хлороводородной кислоты. Получают ее путем растворения в воде газообразного хлороводорода – HCl . Ввиду невысокой его растворимости в воде, концентрация соляной кислоты при обычных условиях не превышает 38%. Поэтому независимо от концентрации соляной кислоты процесс диссоциации ее молекул в водном растворе протекает активно:
HCl H + + Cl -
Образующиеся в этом процессе ионы водорода H + выполняют роль окислителя , окисляя металлы, расположенные в ряду активности левее водорода . Взаимодействие протекает по схеме:
Me + HCl соль + H 2
При этом соль представляет собой хлорид металла (NiCl 2 , CaCl 2 , AlCl 3 ), в котором число хлорид-ионов соответствует степени окисления металла.
Соляная кислота является слабым окислителем, поэтому металлы с переменной валентностью окисляются ей до низших положительных степеней окисления :
Fe 0 → Fe 2+
Co 0 → Co 2+
Ni 0 → Ni 2+
Cr 0 → Cr 2+
Mn 0 → Mn 2+ и др .
Пример:
2 Al + 6 HCl → 2 AlCl 3 + 3 H 2
2│ Al 0 – 3 e - → Al 3+ - окисление
3│2 H + + 2 e - → H 2 – восстановление
Соляная кислота пассивирует свинец ( Pb ). Пассивация свинца обусловлена образованием на его поверхности трудно растворимого в воде хлорида свинца (II ), который защищает металл от дальнейшего воздействия кислоты:
Pb + 2 HCl → PbCl 2 ↓ + H 2
Серная кислота ( H 2 SO 4 )
В промышленности получают серную кислоту очень высокой концентрации (до 98%). Следует учитывать различие окислительных свойств разбавленного раствора и концентрированной серной кислоты по отношению к металлам.
Разбавленная серная кислота
В разбавленном водном растворе серной кислоты большинство ее молекул диссоциируют:
H 2 SO 4 H + + HSO 4 -
HSO 4 - H + + SO 4 2-
Образующиеся ионы Н + выполняют функцию окислителя .
Как и соляная кислота, разбавленный раствор серной кислоты взаимодействует только с металлами активными и средней активности (расположенными в ряду активности до водорода).
Химическая реакция протекает по схеме:
Ме + H 2 SO 4( разб .) → соль + H 2
Пример :
2 Al + 3 H 2 SO 4( разб .) → Al 2 (SO 4) 3 + 3 H 2
1│2Al 0 – 6e - → 2Al 3+ - окисление
3│2 H + + 2 e - → H 2 – восстановление
Металлы с переменной валентностью окисляются разбавленным раствором серной кислоты до низших положительных степеней окисления :
Fe 0 → Fe 2+
Co 0 → Co 2+
Ni 0 → Ni 2+
Cr 0 → Cr 2+
Mn 0 → Mn 2+ и др .
Свинец ( Pb ) не растворяется в серной кислоте (если ее концентрация ниже 80%) , так как образующаяся соль PbSO 4 нерастворима и создает на поверхности металла защитную пленку.
Концентрированная серная кислота
В концентрированном растворе серной кислоты (выше 68%) большинство молекул находятся в недиссоциированном состоянии, поэтому функцию окислителя выполняет сера , находящаяся в высшей степени окисления (S +6 ). Концентрированная H 2 SO 4 окисляет все металлы, стандартный электродный потенциал которых меньше потенциала окислителя – сульфат-иона SO 4 2- (0,36 В). В связи с этим, с концентрированной серной кислотой реагируют и некоторые малоактивные металлы .
Процесс взаимодействия металлов с концентрированной серной кислотой в большинстве случаев протекает по схеме:
Me + H 2 SO 4 (конц.) соль + вода + продукт восстановления H 2 SO 4
Продуктами восстановления серной кислоты могут быть следующие соединения серы:

Практика показала, что при взаимодействии металла с концентрированной серной кислотой выделяется смесь продуктов восстановления, состоящая из H 2 S , S и SO 2. Однако, один из этих продуктов образуется в преобладающем количестве. Природа основного продукта определяется активностью металла : чем выше активность, тем глубже процесс восстановления серы в серной кислоте.
Взаимодействие металлов различной активности с концентрированной серной кислотой можно представить схемой:

Алюминий (Al ) и железо (Fe ) не реагируют с холодной концентрированной H 2 SO 4 , покрываясь плотными оксидными пленками, однако при нагревании реакция протекает.
Ag , Au , Ru , Os , Rh , Ir , Pt не реагируют с серной кислотой.
Концентрированная серная кислота является сильным окислителем , поэтому при взаимодействии с ней металлов, обладающих переменной валентностью, последние окисляются до более высоких степеней окисления , чем в случае с разбавленным раствором кислоты:
Fe 0 → Fe 3+ ,
Cr 0 → Cr 3+ ,
Mn 0 → Mn 4+ ,
Sn 0 → Sn 4+
Свинец ( Pb ) окисляется до двухвалентного состояния с образованием растворимого гидросульфата свинца Pb ( HSO 4 ) 2 .
Примеры:
Активный металл
8 A1 + 15 H 2 SO 4( конц .) →4A1 2 (SO 4) 3 + 12H 2 O + 3H 2 S
4│2 Al 0 – 6 e - → 2 Al 3+ - окисление
3│ S 6+ + 8 e → S 2- – восстановление
Металл средней активности
2 Cr + 4 H 2 SO 4(конц.) → Cr 2 (SO 4) 3 + 4 H 2 O + S
1│ 2Cr 0 – 6e →2Cr 3+ - окисление
1│ S 6+ + 6 e → S 0 - восстановление
Металл малоактивный
2Bi + 6H 2 SO 4( конц .) → Bi 2 (SO 4) 3 + 6H 2 O + 3SO 2
1│ 2Bi 0 – 6e → 2Bi 3+ – окисление
3│ S 6+ + 2 e → S 4+ - восстановление
Азотная кислота ( HNO 3 )
Особенностью азотной кислоты является то, что азот, входящий в состав NO 3 - имеет высшую степень окисления +5 и поэтому обладает сильными окислительными свойствами. Максимальное значение электродного потенциала для нитрат-иона равно 0,96 В, поэтому азотная кислота – более сильный окислитель, чем серная. Роль окислителя в реакциях взаимодействия металлов с азотной кислотой выполняет N 5+ . Следовательно, водород H 2 никогда не выделяется при взаимодействии металлов с азотной кислотой (независимо от концентрации ). Процесс протекает по схеме:
Me + HNO 3 соль + вода + продукт восстановления HNO 3
Продукты восстановления HNO 3 :
Обычно при взаимодействии азотной кислоты с металлом образуется смесь продуктов восстановления, но как правило, один из них является преобладающим. Какой из продуктов будет основным, зависит от концентрации кислоты и активности металла.
Концентрированная азотная кислота
Концентрированным считают раствор кислоты плотностью
ρ > 1,25 кг/м 3 , что соответствует
концентрации > 40%. Независимо от активности металла реакция взаимодействия
с
HNO
3 (конц.)
протекает
по схеме:
Me + HNO 3 (конц.) → соль + вода + NO 2
С концентрированной азотной кислотой не взаимодействуют благородные металлы (Au , Ru , Os , Rh , Ir , Pt ), а ряд металлов (Al , Ti , Cr , Fe , Co , Ni ) при низкой температуре пассивируются концентрированной азотной кислотой. Реакция возможна при повышении температуры, она протекает по схеме, представленной выше.
Примеры
Активный металл
Al + 6 HNO 3( конц .) → Al (NO 3 ) 3 + 3 H 2 O + 3 NO 2
1│ Al 0 – 3 e → Al 3+ - окисление
3│ N 5+ + e → N 4+ - восстановление
Металл средней активности
Fe + 6 HNO 3(конц.) → Fe(NO 3) 3 + 3H 2 O + 3NO
1│ Fe 0 – 3e → Fe 3+ - окисление
3│ N 5+ + e → N 4+ - восстановление
Металл малоактивный
Ag + 2HNO 3( конц .) → AgNO 3 + H 2 O + NO 2
1│ Ag 0 – e → Ag + - окисление
1│ N 5+ + e → N 4+ - восстановление
Разбавленная азотная кислота
Продукт восстановления азотной кислоты в разбавленном растворе зависит от активности металла , участвующего в реакции:

Примеры:
Активный металл
8 Al + 30 HNO 3(разб.) → 8Al(NO 3) 3 + 9H 2 O + 3NH 4 NO 3
8│ Al 0 – 3e → Al 3+ - окисление
3│ N 5+ + 8 e → N 3- - восстановление
Выделяющийся в процессе восстановления азотной кислоты аммиак сразу взаимодействует с избытком азотной кислоты, образуя соль – нитрат аммония NH 4 NO 3 :
NH 3 + HNO 3 → NH 4 NO 3.
Металл средней активности
10Cr + 36HNO 3( разб .) → 10Cr(NO 3) 3 + 18H 2 O + 3N 2
10│ Cr 0 – 3 e → Cr 3+ - окисление
3│ 2 N 5+ + 10 e → N 2 0 - восстановление
Кроме молекулярного азота (N 2 ) при взаимодействии металлов средней активности с разбавленной азотной кислотой образуется в равном количестве оксид азота (I ) – N 2 O . В уравнении реакции нужно писать одно из этих веществ .
Металл малоактивный
3Ag + 4HNO 3( разб .) → 3AgNO 3 + 2H 2 O + NO
3│ Ag 0 – e → Ag + - окисление
1│ N 5+ + 3 e → N 2+ - восстановление
«Царская водка»
«Царская водка» (ранее кислоты называли водками) представляет собой смесь одного объема азотной кислоты и трех-четырех объемов концентрированной соляной кислоты, обладающую очень высокой окислительной активностью. Такая смесь способна растворять некоторые малоактивные металлы, не взаимодействующие с азотной кислотой. Среди них и «царь металлов» - золото. Такое действие «царской водки» объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием хлороксида азота (III ), или хлорида нитрозила – NOCl :
HNO 3 + 3 HCl → Cl 2 + 2 H 2 O + NOCl
2 NOCl → 2 NO + Cl 2
Хлор в момент выделения состоит из атомов. Атомарный хлор является сильнейшим окислителем, что и позволяет «царской водке» воздействовать даже на самые инертные «благородные металлы».
Реакции окисления золота и платины протекают согласно следующим уравнениям:
Au + HNO 3 + 4 HCl → H + NO + 2H 2 O
3Pt + 4HNO 3 + 18HCl → 3H 2 + 4NO + 8H 2 O
На Ru , Os , Rh и Ir «царская водка» не действует.
Е.А. Нуднoва, М.В. Андрюxова
«Классификация кислот» - Классификация кислот по числу атомов водорода. Кислоты. Борная кислота. Классификация кислот. Фтороводородная. Распознавание кислот. Сложные вещества. Продукты питания. Характеристика кислот. Уксусная кислота. Группы. Укусы муравьев. Правила техники безопасности. Что нас объединяет. Хлороводородная (соляная) кислота.
«Кислоты 8 класс» - Какую кислоту добавляют в напитки для придания кислого вкуса? Из какого класса веществ можно получить кислоту? Какая кислота содержится в желудочном соке? Вспомните, что мы знаем о кислотах на примере. Металла(неметалла) Солеобразующий (несолеобразующий) Кислотный (основный). Дайте характеристику оксидам.
«Органические кислоты» - Лимонная кислота получается из листьев махорки и хлопчатника. Молочная кислота. В древности уксусная кислота была известна в виде водных растворов. Молочная кислота в пищевой промышленности. Уксусная кислота в промышленности. Муравьиная кислота в природе. Лимонная кислота в производстве. Выберите раздел.
«Реакции кислот» - BaCL2 + H2SO4 = BaSO4 + 2HCL Ba2+ + SO42- = BaSO4. Типичные реакции кислот. Кислоты. Классификация кислот. Проверь себя. Обобщение. Ответы.
«Химия 8 класс Кислоты» - Кислоты. Значение кислот. Яблочная кислота. Кислоты в природе. Уксус столовый. HCN. Правила техники безопасности при работе с кислотами. Изменение цвета индикаторов в растворах кислот. Кислоты: состав, классификация, значение. Лимонная кислота. Ядовитая кислота. Классификация кислот по содержанию кислорода.
«Кислоты и вода» - Муравей впрыскивает в ранку от укусу яд, содержащий муравьиную кислоту. Кислоты в животном мире. Тропический паук стреляет во врагов струйкой жидкости, содержащей 84% уксусной кислоты. Кислоты в организме человека. Уксусная. Отсюда произошло историческое название серной кислоты – купоросное масло. Некоторые жуки выстреливают струйкой разбавленной серной кислоты.
Реакция 1. Металл + кислота = соль + водород
Тип реакции - реакция замещения
.
Признак реакции - выделение газа.
При составлении уравнений реакций не забывать, что водород выделяется в виде двухатомных молекул H 2 !
Осуществимость - необходимо выполнение двух условий:
1) с кислотами (кроме азотной и концентрированной серной) реагируют только металлы, находящиеся в ряду активностей металлов до водорода (см. схему);
2)при реакции металлов с азотной и концентрированной серной кислотами водород не выделяется
, эти кислоты действуют на металлы по своим законам. Кремниевая кислота вообще не реагирует с металлами
, потому что не растворяется в воде.
Пример: С какими из перечисленных веществ вступает в реакцию хлороводородная (соляная) кислота: Na 2 О, Сu, SO 3 , Zn? Составьте уравнения возможных реакций.
1. Определяем принадлежность заданных в условий веществ к соответствуюцим классам и тут же проверяем, реагируют ли они с кислотами. Получается:
Na 2 О - основный оксид - реагирует (получается соль и вода);
Си - металл, находящийся в ряду активности после водорода, - не реагирует;
SOз - кислотный оксид - не реагирует;
Zn - металл, находящийся в ряду активности до водорода, - реагирует (получается соль и водород).
2. Чтобы составить уравнения реакций, определим валентность металлов (натрий - I, цинк - II) и составим формулы солей учитывая, что валентность кислотного остатка Сl составляет I. Осталось записать уравнения реакций:
Na 2 О + 2НСl = 2NaCl + Н 2 О;
Zn + 2НСl= ZnCl 2 + H 2 .
Реакция 2. основный оксид + кислота = соль + вода
Тип реакции - реакция обмена
.
Составить уравнение этой реакции проще, чем уравнение реакции 1, потому что формула кислоты нам уже известна; зная ее, просто получить и формулу кислотного остатка, и его валентность.
Дальше поступаем так же, как и в предыдущем примере. При составлении уравнения реакции не забудем, что выделяется вода!
Пример: Составьте уравнение реакции между оксидом алюминия и хлороводородной кислотой.
1. Вспомним формулу хлороводородной кислоты - НСl, ее остаток Сl(хлорид) имеет валентность I.
2. По периодической системе Д.И. Менделеева установим, что валентность алюминия III и формула его оксида Аl2Оз.
3. Составим формулу продукта реакции - соли (хлорида алюминия): АlСlз.
4. Запишем уравнение реакции и подберем в нем коэффициенты:
Аl2Оз + 6HCl = АlСlз + 3H2O
Реакция 3. Основание + кислота = соль + вода
Эта реакция носит специальное название - реакция нейтрализации, потому что в ходе ее кислота и основание как бы взаимно уничтожаются.
Тип реакции - реакция обмена.
Признаки реакции: выделение тепла, изменение окраски индикатора, для нерастворимых гидроксидов- исчезновение осадка.
Чтобы составить уравнение реакции нейтрализации нужно сделать следующее:
1) определить валентности металла и кислотного остатка;
2) составить формулу образующейся соли;
3) записать уравнение реакции и подобрать коэффициенты.
(фото как из малинового раствора при добавлении кислоты получается прозрачный раствор; фото2 –к голубому осадку прилили кислоту и он растворился)
Реакция между кислотой и основанием в результате которой образуется соль и вода называется реакцией нейтрализации .
NaOH + HCl = NaCl + H 2 O
Реакция 4. Кислота + соль = новая кислота + новая соль
Тип реакции - реакция обмена
.
Признаки реакции - выпадение осадка или выделение газа. Осуществимость: реакция возможна, если получается нерастворимая соль (см таблицу растворимости) или нерастворимая, нестойкая или летучая кислота.
Полезно знать: что среди важнейших кислот, содержащихся в таблице:
- нерастворимая - кремниевая (H 2 SiO 3);
- нестойкие - угольная (Н 2 СОз = H 2 O + CO 2) и сернистая (Н 2 SОз = Н 2 О + SO 2);
- летучие - сероводородная (H 2 S), а также НСl, HBr, HI, НNОз - но только в отсутствии воды и при нагревании.
Чтобы составить уравнение реакции, надо проделать следующие операции:
1) составить схему реакции, для чего определить формулы получающихся соли и кислоты (в этом лучше всего поможет таблица растворимости или знание валентности);
2) проверить условие осуществимости реакции (таблица поможет и в этом);
3) если реакция осуществима - записать уравнение реакции. Если получаются угольная или сернистая кислоты - сразу записать продукты их разложения (оксид и воду).
HCl + AgNO 3 = AgCl â + HNO 3
Выполните предложенные упражнения:
1.Закончите уравнения реакций и подберите коэффициенты:
а) СаО+НзРО4 -> б) Na2О +Н2СОз ->
в) Fе2Оз + H2SО4 -> г) ZnO + HNО3 ->
2.Составьте уравнения реакций между веществами: а) иодоводородная кислота и оксид бария; б) серная кислота и оксид железа (III); в) азотная кислота и оксид лития; г) фосфорная кислота и оксид калия.